Números cuánticos y su relación con la tabla periódica
En el mundo
microscópico de los átomos, partículas nucleares y subnucleares, pueden ocurrir
hechos que son impensables en el mundo macroscópico en el que recogemos toda
nuestra experiencia. Por lo tanto, explicar este tipo de fenómenos es
extremadamente difícil, ya que son hechos contrarios a nuestra intuición.
Las sustancias
están formadas por distintos átomos o por distintas moléculas. Los electrones
de cada átomo o molécula tienen niveles de energía definidos que son característicos
de ese átomo o molécula.
Por lo tanto, para poder explicar el comportamiento de
dichas partículas, no solo basta considerar los principios de la mecánica
clásica, sino más bien hablar en términos de la mecánica cuántica. Esta última,
nos dice que una partícula se distribuye en el espacio y que existe una
probabilidad de encontrarla en algún punto; mientras que la mecánica clásica
nos dice que una partícula se mueve describiendo una trayectoria definida.
La base de la
mecánica cuántica es el PRINCIPIO DE INCERTIDUMBRE, formulado por el físico
alemán Werner Heisenberg. Según el principio de incertidumbre, no es posible
determinar el valor preciso de la velocidad de una partícula y, simultáneamente
el de su posición.
Una conclusión
muy importante a la que se llega a partir del principio de incertidumbre es que
cuanto más pequeño es el espacio en el que se confina una partícula, mayor es
su energía. Esto es un hecho debido a que en el mundo de dimensiones muy
pequeñas la energía aumenta de a saltos, llamados cuantos de energía y por lo
tanto no hay valores intermedios de energía.
La mecánica
cuántica permite construir una estructura para los átomos, ubicar en qué zonas
del espacio es más probable encontrar los electrones de un átomo.
La energía de
un electrón en un átomo y la zona donde es más probable encontrarlo están
relacionadas con el modelo que provee la Mecánica y es posible encontrar esta
relación, que queda expresada en términos de 4 números llamados números
cuánticos del electrón.
Por lo tanto, para saber cuál es la estructura la
estructura de un determinado átomo debemos conocer el valor que toman los
números cuánticos para cada uno de los electrones.
Estos números
cuánticos se representan mediante símbolos determinados y cada uno de ellos
tiene un nombre propio y un significado. En la siguiente imagen se muestra esta
información:
Nombre del número cuántico
|
Símbolo
|
Significado
|
Numero cuántico principal
|
n
|
Nivel energético del orbital
|
Numero cuántico secundario o
azimutal
|
l
|
Describe la forma geométrica del orbital
|
Numero cuántico magnético
|
m
|
Indica la orientación del
orbital en el espacio
|
Numero cuántico de spin
|
s
|
Indica el giro del electrón sobre su propio eje
|
Valores que pueden tomar estos números cuánticos
Los números cuánticos no surgen
de la observación, sino que constituyen representaciones matemáticas de dichos
fenómenos. Estos números se originan a partir del desarrollo de las ecuaciones
postuladas por el modelo atómico de la mecánica cuántica y esto lleva a que
cada número cuántico tiene permitidos determinados valores y solo esos. La
validación de estos números cuánticos se sustenta en que permiten explicar la
estructura atómica y la Clasificación Periódica de los elementos de una manera
muy satisfactoria.
Número cuántico
|
Valores
|
Relación con la tabla periódica
|
Principal (n)
Indica el nivel de energía
del orbital
|
n= 1, 2, 3, 4, 5, 6, 7.
Todos los electrones de un átomo
que poseen el mismo valor de n constituyen la capa de electrones.
|
El mayor valor de “n” indica a qué periodo de la tabla periódica pertenece el átomo.
|
Número cuántico
|
Valores
|
Relación con la tabla periódica
|
Secundario (l)
Indica la forma del orbital
|
Para determinar el valor de “l”
es necesario aplicar la siguiente formula l=n-1
Por lo tanto los valores para ”l” serán
l= 0, 1, 2, 3, 4, 5, 6
por razones históricas a cada
valor de l le corresponde una forma de orbital determinado, que se representa
por una letra, quedando de la siguiente manera:
l=0, 1, 2, 3, 4, 5, 6
l=s, p, d, f
|
El valor del número cuántico
secundario de un electrón indica en qué bloque de la tabla periódica estará
el elemento.
|
Número cuántico
|
Valores
|
Relación con la tabla periódica
|
Magnético (m)
Indica la orientación del
orbital
|
Puede tomar valores entre - ℓ...0...+ℓ. Por lo tanto, su valor solo depende
del número cuántico secundario
Solo
pueden tomar valores enteros que van desde –3 hasta +3, incluyendo el cero. Por
ejemplo: si el valor de l=1, los valores que tomará m serán m= -1, 0, +1
Este
número cuántico nos da indicios sobre cuantos orbitales contiene un átomo,
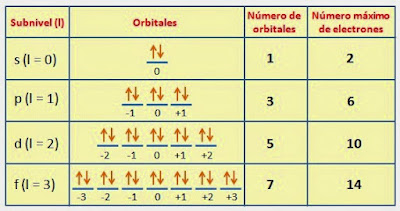
quedando los valores como se muestran en la siguiente figura:
|
No tiene relación
|
Número cuántico
|
Valores
|
Relación con la tabla periódica
|
Spin (s)
Indica el giro del electrón
|
Los valores de “s” sólo son dos:
+1/2 y -1/2.
Cada uno de estos valores indica
el sentido de giro del electrón sobre su propio eje, como se muestra en la
siguiente figura:
|
No tiene relación.
|




.l.
ResponderEliminarMuy útil
ResponderEliminarMuy buena información, me ayudo mucho:)
ResponderEliminarpasen actividades del parcial 2
ResponderEliminarQuien de la ateneo
ResponderEliminar✌️
Eliminar